Die rheumatoide Arthritis hat als häufigste rheumatische Systemerkrankung mit einer Prävalenz von 0,3 bis 1,0 % auch in der Hausarztpraxis einen großen Stellenwert. Sie verläuft chronisch-rezidivierend und führt unbehandelt zu Gelenkschäden bis hin zur Destruktion und schließlich Ankylose mit Funktionsverlust. Heutzutage stehen jedoch eine Reihe von Medikamenten zur Verfügung, die eine differenzierte Therapie erlauben.
- Vor zwei Jahren klagte die damals 31-jährige Patientin über Schmerzen im linken Fuß, im Bereich MTP III mit sichtbarer Schwellung und schmerzbedingt erschwertem Laufen. Es wurde der V.a. M. Köhler geäußert und eine operative Therapie vorgeschlagen.
- Wenige Monate später kamen Schmerzen der Finger- und Handgelenke hinzu mit sichtbarer Schwellung sowie schubartig auftretende Schmerzen im Schlüsselbeinbereich, teils mit Ausstrahlung in die Arme und in den oberen Rückenbereich. Bei Bewegungen fiel ihr manchmal das Atmen schwer. Hüftschmerzen führten dazu, dass sie kaum schlafen konnte.
- Vor Kurzem hatte sie wegen eines geschwollenen Kniegelenks einen Orthopäden aufgesucht, der zweimal punktiert und Prednisolon injiziert hatte. Danach hatte sich der Befund sehr gebessert.
- nzwischen hatte sich eine Morgensteifigkeit für ca. 2 – 3 h entwickelt, die sich durch Bewegung besserte. Novalgin und Ibuprofen halfen gegen die Schmerzen nur geringfügig.
- Diagnose: seropositive, ACPA-positive rheumatoide Arthritis (rA).
- Eine Therapie über ein Jahr mit Methotrexat wurde wegen nicht ausreichendem Ansprechen auf Certolizumab pegol umgesetzt. Wegen Haarausfall und Übelkeit (MTX) und Injektionsschmerzen
- von Certolizumab pegol sowie Wunsch einer oralen Therapie und fehlender Kontraindikationen erfolgte die Umstellung auf Upadacitinib. Darunter ist sie steroidfrei, hinsichtlich der rA erscheinungsfrei und voll arbeitsfähig.
Frauen sind, wie bei vielen rheumatischen Systemerkrankungen, häufiger betroffen als Männer. Am häufigsten erkranken Frauen um das 60. Lebensjahr (Männer etwas später), wobei auch deutlich jüngere oder ältere Menschen betroffen sein können. Pathophysiologisch kommt es zu einer Inflammation der Synovia, der Gelenkhaut, die man als Synovialitis bezeichnet.
Die Erkrankung betrifft in erster Linie periphere Gelenke. Das typische Muster mit Befall der Fingergrund- und -mittelgelenke, des Handgelenks und der Zehengrundgelenke 2 – 5 liefert einen wichtigen differenzialdiagnostischen Hinweis im Vergleich zur Polyarthrose. Letztere betrifft neben Hüft- und Kniegelenken typischerweise Fingermittel- und -endgelenke, Daumensattel- und Großzehengrundgelenke.
Anamnestisch berichten die Patient:innen von wechselnden und schmerzhaften Gelenkschwellungen mit konsekutiver Funktionseinschränkung von Händen und Füßen sowie großen Gelenken. Typisch sind nächtlicher Schmerz und Ruheschmerz sowie Steifigkeit am Morgen und erneut nach Ruhephasen. Teilweise hält die Steifigkeit über Stunden an.
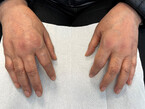
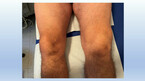
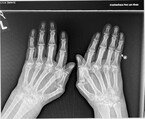
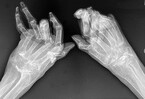
Bei der klinischen Untersuchung ist vor allem die Untersuchung von Händen und Füßen wegweisend, wo die Erkrankung sich mit sicht- und tastbaren teigigen Schwellungen der betroffenen Gelenke (typischerweise Handgelenk, Metacarpophalangealgelenke (MCP), Metatarsophalangealgelenke (MTP) und proximale Interphalangealgelenke (PIP)) zeigt und hier zu Schmerzen und Bewegungseinschränkungen führt (Abb. 1, 3 und 4). Häufig ist den Patient:innen der Faustschluss erschwert und der Händedruck schmerzhaft (positives Gaenslen-Zeichen). Eine Synovialitis der MTP verursacht eine Querdruckdolenz der Vorfüße (ebenfalls genannt positives Gaenslen-Zeichen). Auch große Gelenke können betroffen sein, hier ist ein Gelenkerguss am einfachsten im Bereich des Kniegelenks zu palpieren (Abb. 2).
Die rheumatoide Arthritis kann mit Laborveränderungen wie erhöhten Entzündungsparametern (C-reaktives Protein, Blutsenkungsgeschwindigkeit) und Blutbildveränderungen (Anämie, Thrombozytose) einhergehen. Diese labordiagnostischen Veränderungen sind jedoch nicht obligat zur Diagnosestellung. Hinsichtlich der Immunserologie können Rheumafaktor und/oder ACPA/Anti-CCP-Antikörper vorliegen, wobei hohe Titer für ACPA mit einer schlechteren Prognose assoziiert sind. Andererseits kommen insbesondere in der älteren Bevölkerung leicht erhöhte Titer für Rheumafaktor vor, ohne dass hier eine rheumatoide Arthritis vorliegt. Diese Befunde sind dann ohne Krankheitswert, führen jedoch immer wieder zur Verunsicherung der Patient:innen.
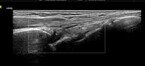
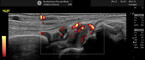
Zur Diagnostik der rheumatoiden Arthritis ist neben der Anamnese, der klinischen Untersuchung und den Laborbefunden die Arthrosonographie die Bildgebung der Wahl (Abb. 5 und 6). Hier sind Ergussbildung, synoviale Proliferation und die für das Erkrankungsbild typische Hypervaskularisation im Powerdoppler darstellbar sowie neben Arthritiden (Gelenkentzündungen) auch Tenosynovitiden (Sehnenscheidenentzündungen) nebst frühen knöchernen Schäden in Form von Erosionen.
Hinsichtlich der Behandlung sind Nikotinkarenz und eine mediterrane, fleischarme Kost sinnvoll, aber in der Regel nicht ausreichend, um die Erkrankung zu kontrollieren. Aufgrund der starken Gefährdung von Lebensqualität und Erwerbsfähigkeit einerseits und der heutzutage erfreulich guten Auswahl an medikamentösen Therapiemöglichkeiten andererseits ist es empfehlenswert, die Erkrankung nach möglichst früher Diagnosestellung konsequent zu behandeln.
Antiphlogistika (NSAR und Coxibe) dienen grundsätzlich als Bedarfsmedikation. Des Weiteren werden nach wie vor Glukokortikoide als Ersttherapie und auch zur Therapie von Schüben eingesetzt. Hier ist Prednisolon der häufigste Vertreter und kann zu Beginn mit 20 – 30 mg Tagesdosis (15-0-5 oder 20-0-10 mg) dosiert werden, höhere Dosierungen sind nur selten erforderlich. Nach aktuellen Empfehlungen sollte die Steroidtherapie aufgrund der steroidassoziierten Langzeitnebenwirkungen so kurz wie möglich (8 Wochen bis zu einer Dosis ≤ 7,5 mg Prednisolon/Tag) eingesetzt und innerhalb des ersten halben Jahres wieder beendet werden. Zudem sollte bereits der frühe Einsatz mit einer regelmäßigen Vitamin-D-Substitution (800 – 1.000 IE/d) kombiniert werden, um der steroidassoziierten Osteoporose vorzubeugen. Je nach Risikoprofil und Alter des Patienten:innen empfiehlt sich bereits zu Therapiebeginn eine DXA-Kontrolle.
Trotz neuer medikamentöser Optionen ist nach wie vor Methotrexat Standard-Basistherapeutikum in der Behandlung der rheumatoiden Arthritis. Methotrexat kann oral oder parenteral appliziert werden, wobei die orale Bioverfügbarkeit etwas schlechter anzusehen ist. In der Regel wird eine Dosis von 15 – 20 mg pro Woche gewählt in Kombination mit einer oralen Folsäure-Substitution von 5 mg am Folgetag. Folsäure verbessert die Verträglichkeit von Methotrexat.
Im Allgemeinen wird Methotrexat gut vertragen. Allerdings kann es zu Beginn oder auch im Verlauf der Therapie zu Stomatitis, Kopfschmerzen, Müdigkeit, Unwohlsein oder gastrointestinalen Nebenwirkungen wie Übelkeit, Erbrechen und Aversion kommen. Dosisreduktion oder Wechsel der Applikationsart (oral auf parenteral oder umgekehrt) können helfen, aber erfahrungsgemäß kann eine Methotrexat-Basistherapie dann meist nicht mehr aufrechterhalten werden. Unter Methotrexat-Therapie ist auf eine strenge Kontrazeption zu achten.
Unter Methotrexat – wie auch unter immunsuppressiven Basistherapeutika im Allgemeinen – sind regelmäßige, mindestens zwölfwöchentliche Laborkontrollen empfehlenswert, um laborchemische Nebenwirkungen wie Blutbildveränderungen oder Leberwerterhöhungen zu erfassen. Aufgrund der renalen Elimination von Methotrexat ist zudem auf eine ausreichend gute Nierenfunktion zu achten, bei einer GFR unter 60 ml/min sollte Methotrexat nur dosisreduziert eingesetzt werden, ab einer GFR unter 30 ml/min ist es streng kontraindiziert. Im Rahmen einer Niereninsuffizienz kann es zur Kumulation von Methotrexat mit erhöhter Toxizität kommen. Ebenfalls erhöht die Komedikation von Cotrimoxazol die Toxizität von Methotrexat. Alkohol sollte unter Therapie vermieden werden.
Selten aber beachtenswert ist die Methotrexat-induzierte Pneumonitis, die sich bereits im ersten halben Jahr nach Therapiebeginn, aber auch im weiteren Verlauf manifestieren kann und charakterisiert ist durch trockenen Husten, Dyspnoe und teils auch febrile Temperaturen. Methotrexat sollte dann unverzüglich beendet werden und eine Re-Exposition aufgrund erhöhter Letalität nicht mehr erfolgen. Diagnostisch ist neben der Anamnese die Bildgebung hilfreich, wobei hier teilweise ein konventionelles Röntgen nicht ausreicht und eine CT des Thorax ergänzt werden muss. Therapeutisch sind Kortikosteroide und teilweise auch Folsäure notwendig.
Alternativ zu Methotrexat können entweder die konventionellen DMARDs (disease modifying anti-rheumatic drugs/Basismedikamente) Leflunomid oder Sulfasalazin eingesetzt werden (beides orale Substanzen mit täglicher Gabe, Sulfasalazin-Einsatz auch in der Schwangerschaft und Stillzeit möglich).
Basistherapeutika wie Azathioprin, Ciclosporin oder gar Gold haben heute keinen Stellenwert mehr in der Behandlung der rheumatoiden Arthritis. Hydroxychloroquin als Anti-Malariamittel wird nur in wenigen Fällen eingesetzt und spielt stattdessen eine zentrale Rolle in der medikamentösen Therapie des systemischen Lupus erythematodes.
Erfreulicherweise haben in den letzten 20 Jahren sukzessiv neue Substanzen (Biologika, Biosimilars und JAK-Inhibitoren) die Zulassung zur Behandlung der rheumatoiden Arthritis erhalten. Diese umfassen orale, subkutane und intravenöse Therapeutika mit unterschiedlichem Wirkmechanismus (Inhibition inflammatorischer Zytokine wie TNFalpha oder Interleukin-6, T-Zell- oder B-Zell-gerichtete Immunsuppression) und können nach Versagen eines konventionellen DMARDs (in der Regel Methotrexat) bereits eingesetzt werden (Ausnahme Rituximab als Second-Line-Therapie). Einzelne Substanzen können auch in Mono-Therapie (ohne Komedikation mit Methotrexat) angewandt werden.
Durch die mittlerweile große Anzahl an Immunsuppressiva kann differenzierter auf die Erkrankungssituation unter Berücksichtigung der Komorbiditäten der einzelnen Patienten:innen eingegangen und auch zunehmend dem Patientenwunsch (Tablette versus Spritze) entsprochen werden. Im Hinblick auf die Sicherheit ist neben den oben genannten Laborkontrollen auf eine erhöhte Infektneigung zu achten, die in der Praxis bei gut eingestellter Grunderkrankung und erfolgreicher Beendigung von Prednisolon meist nur selten problematisch ist. Hier ist die Auffrischung des Impfstatus (unter anderem Immunisierung gegen Pneumokokken, Influenza, SARS-CoV-2 und Herpes zoster) empfehlenswert.
Bezüglich des perioperativen Managements der DMARDs bieten die Empfehlungen der Deutschen Gesellschaft für Rheumatologie (DGRH) eine übersichtliche Hilfestellung. Zudem können die DGRH-Therapieüberwachungsbögen der einzelnen Immunsuppressiva im allgemeinmedizinischen Alltag rasche Orientierung bezüglich notwendiger Kontrollen, Neben- und Wechselwirkungen bieten.
Neben allen medikamentösen Therapieoptionen sollen die unverzichtbaren nichtmedikamentösen Therapiesäulen der Physio- und Ergotherapie und physikalischen Therapie im ambulanten Setting oder im Rahmen von Rehabilitationsmaßnahmen nicht unerwähnt bleiben.
- Die rheumatoide Arthritis befällt v. a. Grundgelenke von Fingern und Zehen und Handgelenke.
- Laborchemisch können Rheumafaktor und/oder Anti-CCP-Antikörper vorliegen.
- Zur Therapie kommen Prednisolon, Methotrexat und andere konventionelle DMARDs sowie Biologika infrage.
Dr. Anastasia Bühner-Chakravertty
Erschienen in: doctors|today, 2023; 3 (8) Seite 32-35