Für immunsupprimierte Patient:innen können Schimmelpilzsporen gefährlich werden. Invasive Pilzinfektionen (IFD – Invasive fungal diseases) enden mitunter tödlich. Die Diagnostik ist schwierig und die Therapie oft langwierig. Es stehen nur wenige Substanzklassen zur Verfügung, die im Vergleich zu antibakteriellen Therapeutika weniger gut wirken. Da diese Behandlung zunehmend auch ambulant stattfindet, ist hier auch der Hausarzt gefordert.
Das Risiko für eine IFD steigt mit dem Ausmaß der Immunsuppression. Als Hochrisikopatient:innen gelten Menschen mit hämatologischen Neoplasien mit längerer Neutropeniedauer (< 500 neutrophile Granulozyten/μl für mehr als zehn Tage). Betroffen sind z. B. Patient:innen mit akuter myeloischer Leukämie oder nach allogener Stammzelltransplantation. Patient:innen nach einer Lungentransplantation sind ebenfalls Hochrisikopatient:innen. In diesen Situationen werden zur Prophylaxe für einen bestimmten Zeitraum Antimykotika empfohlen.
Ein erhöhtes Risiko für IFD, aber ohne Empfehlung für eine Pilzprophylaxe, haben hämatologische Patient:innen mit kürzerer Neutropeniedauer sowie organtransplantierte Patient:innen, die andere Organe als eine Lunge erhalten haben. Auch die Einnahme von Steroiden über einen längeren Zeitraum prädisponiert für eine IFD. Als prolongierte Einnahme wird ein Zeitraum von mehr als drei Wochen mit einer Dosis von ≥ 0,3 mg/kg bezeichnet [1]. Auch andere immunsuppressive Substanzen erhöhen das Risiko. Das sind B-Zellinhibitoren (z. B. Bruton-Tyrosinkinase-Inhibitoren) oder T-Zellinhibitoren (z.B. Calcineurin-Hemmer oder TNF-alpha-Blocker). Bei einigen angeborenen Immundefekten treten gehäuft Pilzinfektionen auf (z. B. chronische Granulomatose) [1].
Bei Intensivpatient:innen wird in bestimmten Situationen eine erhöhte Inzidenz für IFD beobachtet. Seit einigen Jahren ist bekannt, dass Influenza-Patient:innen auf der Intensivstation mit 14 % ein deutlich erhöhtes Risiko für pulmonale Aspergillus-Infektionen (IAA - Influenza-associated Aspergillosis) haben. Falls zusätzlich eine Immunsuppression besteht, beträgt das IAA-Risiko sogar 31 %. Bei nicht immunsupprimierten Patienten, die wegen einer schweren CAP (community acquired pneumonia) auf der Intensivstation liegen, beträgt das Risiko für eine invasive pulmonale Aspergillose (IPA) nur etwa 5 % [2]. Für intensivpflichtige COVID-19-Patientenvariieren die Daten über Inzidenzen der pulmonalen Aspergillusinfektionen in Studien stark.
Für Diabetes mellitus, besonders bei schlecht eingestelltem Blutzucker, sind ebenfalls IFD beschrieben, häufiger treten hier aber chronische Schimmelpilzmanifestationen auf.
Schimmelpilze mit humanpathogener Bedeutung
Verglichen mit bakteriellen Infektionen sind IFD glücklicherweise seltene infektiologische Komplikationen. Spitzenreiter unter den Schimmelpilzen ist Aspergillus spp., mit Aspergillus fumigatus als häufigstem Vertreter. Die Inzidenz bei Höchstrisikopatient:innen (allogene SCT) liegt bei 6 % [4]. Mucorales (früher Zygomycetes) stehen auf dem zweiten Platz mit weltweit sehr unterschiedlichen, aber insgesamt steigenden Inzidenzen (Hochrisikopatienten: Europa und USA 0,2 bis 3,5 %; Indien deutlich höher). Die Zunahme wird durch den steigenden Anteil an Risikopatient:innen mit Immunsuppression in Europa und USA, den prophylaktischen Einsatz von Azolen und die weltweit steigende Diabetes-mellitus-Prävalenz (mit schlechter Blutzuckereinstellung) erklärt [3]. Alle anderen invasiven Schimmelpilzinfektionen sind außerordentlich selten. Dazu gehören u. a. Fusariose, Lomentosporiose und Scedosporiose. Die folgende Darstellung bezieht sich auf IFD durch Aspergillus spp. und Mucor spp.
Mykologie und klinische Manifestation
Pilzsporen kommen ubiquitär vor, v.a. in der Erde. Eine Exposition kann nicht verhindert, höchstens reduziert werden. Eine besonders hohe Belastung findet sich beispielsweise in der Umgebung von Baustellen. Diese sollten in Krankenhäusern besonders abgeschirmt sein, wenn sich Immunsupprimierte in der näheren Umgebung befinden. Die Aufnahme erfolgt überwiegend durch die Inhalation von Sporen. Auch eine Inokulation über Wunden (z. B. Brandverletzte) ist möglich. Nach der Aufnahme von Pilzsporen hängen die klinischen Manifestationen vom Immunstatus ab. Das Spektrum reicht von asymptomatischen Kolonisationen bis hin zu schweren, invasiven Infektionen.
Die invasiven IFD manifestieren sich mit Abstand am häufigsten in der Lunge, eine Dissemination in prinzipiell jedes Organ ist möglich. Primär oder durch Dissemination sind auch häufiger die Nebenhöhlen betroffen. Eine gefürchtete Komplikation sinusoidaler Infektionen ist eine kontinuierliche Ausbreitung in das ZNS [5].
Die Mortalität von IFDs ist insgesamt hoch und abhängig vom Ort der Infektion sowie dem Ausmaß der Immunsuppression. Die höchste Mortalität mit rund 85 % haben Patient:innen mit ZNS-Manifestationen oder disseminierter Infektion [6]. In einer spanischen Studie wurde die Case Fatality Rate (CFR) von invasiver Aspergillose über zwei Jahrzehnte untersucht. Bei steigenden Fallzahlen war die CFR gesunken auf 20,8 % im Jahr 2017 (kommend von 27,8 % 1998) [7].
Management von IFD – was ist daran so schwierig?
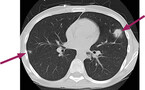
Invasive Pilzinfektionen sind schwer zu diagnostizieren. Goldstandard ist ein mikroskopischer oder kultureller Nachweis von Pilzstrukturen in primär sterilem Material. Dies erfordert invasive diagnostische Prozeduren bei sehr vulnerablen Patient:innen, oft mit wenigen Thrombozyten – leider selten durchführbar. Praktikabler sind mykologische Nachweismethoden aus respiratorischem Material oder Aspirat der Nebenhöhlen sowie der indirekte Nachweis von Biomarkern im Serum, respiratorischem Material oder Liquor [1]. Leider kann anhand dieser Ergebnisse nicht sicher zwischen Kolonisation oder invasiver Infektion diskriminiert werden. Die – oft unspezifische – Klinik hilft hier nicht weiter. Zur Evaluation pulmonaler und sinusoidaler Infektionen spielt die Radiologie (Schnittbildgebung, nicht Röntgen) eine wichtige Rolle (Abb. 1). Aber auch hier sind sämtliche pilztypischen Zeichen unspezifisch, mit einer langen Liste an Differenzialdiagnosen. Um die Wahrscheinlichkeit einer IFD abschätzen zu können, müssen alle Bausteine berücksichtigt werden: Klinik, Mikrobiologie, Histologie, Radiologie und das Vorhandensein von Risikofaktoren. Die schwierige Diagnostik und die Tatsache, dass ein verspäteter Behandlungsbeginn bei IFDs mit einer ungünstigen Prognose verbunden ist, führen in vielen Fällen zu einem Overtreatment bei Hochrisikopatient:innen.
Antimykotische Therapie
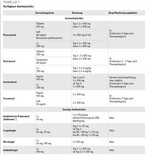
Zur Therapie von IFDs stehen drei Substanzklassen zur Verfügung, Azole, Polyene und Echinocandine (vgl. Tabelle 1). Das ist keine besonders große Auswahl, verglichen mit den antibakteriell wirksamen Substanzen. Außerdem sind die Ansprechraten der antimykotischen Substanzen deutlich schlechter. Zu einer endgültigen Rekonstitution kommt es z. B. bei hämatologischen Patientenhäufig erst, wenn sich das Immunsystem wieder erholt hat.
Für die Primärprophylaxe und die Sekundärprophylaxe bei Hochrisikopatient:innen werden Azole eingesetzt, welche auch die Erstlinientherapie für Aspergillus-Infektionen sind. So stehen bei refraktären oder Durchbruchinfektionen nur noch zwei weitere Klassen zur Auswahl [8, 9, 10]. Da die Therapie von IFDs sehr lange dauern kann, sind auch Hausärzt:innen häufig involviert.
Die Azole sind oral und i.v. verfügbar. Während der Therapie muss das hohe Interaktionspotenzial der Azole (Klasseneffekt), insbesondere von Voriconazol, bedacht und ein Interaktionscheck für Begleitmedikation gemacht werden. Für einige Azole ist zur Sicherstellung therapeutischer oder prophylaktischer Spiegel sowie zur Vermeidung von Toxizität therapeutisches Drug-Monitoring (TDM) dringend empfohlen (Voriconazol und Posaconazol-Suspension). Für Isavuconazol gibt es noch keine eindeutigen Empfehlungen und für Posaconazol Tabletten wird davon ausgegangen, dass ausreichende Spiegel erreicht werden. In fraglichen Situationen kann TDM aber trotzdem hilfreich sein. Unter Azoltherapie kann es zu Leberenzymerhöhungen kommen. Farbsehstörungen sind eine typische Nebenwirkung von Voriconazol. Itraconazol wird aufgrund von erratischen Spiegeln kaum mehr eingesetzt.
Der wichtigste Vertreter der Polyene ist liposomales Amphotericin B. Konventionelles Amphotericin B wird aufgrund der Nephrotoxizität so gut wie nicht mehr eingesetzt. Auch unter liposomalem Amphotericin B kommt es – besonders nach längerer Therapiedauer – zu erhöhten Kreatinin-Werten. Diese sind in der Regel reversibel. Sehr häufig tritt unter Therapie eine substitutionspflichtige Hypokaliämie auf. Polyene sind nur i.v. verfügbar. Falls Patient:innen die Substanz über ambulante Dienstleister erhalten, sollten regelmäßig Nierenwerte und Kaliumwerte kontrolliert werden.
Echinocandine (Caspofungin, Anidulafungin, Micafungin) sind vom Nebenwirkungs- und Interaktionsprofil günstig. Eine Applikation ist nur i.v. möglich. Für Mucorales sind Echinocandine nicht wirksam. Echinocandine haben ihren Platz v. a. in der Salvagetherapie und in der empirischen Therapie. Außerdem werden sie bei refraktären oder komplizierten Pilzinfektionen als Kombinationspartner eingesetzt, allerdings bei dünner Datenlage [8, 9, 10].
Ausblick
Pilztherapie hat viele Limitationen, darunter die Dosis-limitierende Toxizität, die Interaktionen, Resistenzen und fehlende Step-down-Möglichkeiten, da nur Azole oral verfügbar sind. In den letzten 20 Jahren wurde keine neue Antimykotika-Klasse zugelassen. Isavuconazol wurde als einzige Substanz in den vergangenen zehn Jahren zugelassen. Nun gibt es aber einige vielversprechende neue Klassen und Substanzen in der Pipeline. Darunter sind antifungale Wirkstoffe mit günstigen pharmakokinetischen Eigenschaften, so dass eine einmal wöchentliche i.v.Applikation getestet wird und mehrere Wirkstoffe, die p.o. appliziert werden sollen. Einige der in Entwicklung stehenden Antimykotika haben ein sehr interessantes Wirkspektrum, das auch die sehr seltenen Schimmelpilze oder resistente Candida spp. abdeckt [11]. Hier darf man gespannt sein.
- Je höher das Ausmaß der Immunsuppression, desto höher das Risiko für eine invasive Pilzinfektion (IFD).
- IFD manifestieren sich am häufigsten in der Lunge.
- Die antimykotische Therapie hat viele Limitationen wie Toxizität, Interaktionen und Resistenzen.
Dr. Heidi Horns
Erschienen in: doctors|today, 2023; 3 (7) Seite 30-33